Translationale Forschung bei Motoneuronerkrankungen & Mechanismen axonaler Degeneration
Ziel unserer Arbeit ist das bessere Verständnis der pathophysiologischen Mechanismen von neurodegenerativen Erkrankungen mit Fokus auf der axonalen Degeneration sowie die Weiterentwicklung therapeutischer Verfahren bei Motoneuronerkrankungen. Dabei arbeiten wir sowohl grundlagenwissenschaftlich als auch klinisch.
Mechanismen der axonalen Degeneration
Im Labor untersuchen wir die Mechanismen, die der axonalen Degeneration zugrunde liegen. Das Axon ist der längste Fortsatz einer Nervenzelle und überträgt Signale zu den Zielstrukturen (andere Nervenzellen, Muskeln, Drüsen u.a.). Ist das Axon geschädigt, kann eine Nervenzelle ihre Funktion nicht mehr ausüben.
Axonale Degeneration findet sich sehr früh im Krankheitsverlauf bei vielen neurodegenerativen Erkrankungen wie M. Parkinson, M. Alzheimer und Motoneuronerkrankungen und geht dem Zelltod der Nervenzelle häufig voraus. Auch bei akuten traumatischen Erkrankungen wie z.B. der Querschnittslähmung kommt es zur axonalen Degeneration.
Somit ist die axonale Degeneration ein zentrales und frühes Merkmal vieler neurologischer Erkrankungen mit folgender sofortiger funktioneller Einschränkung und ein vielversprechender therapeutischer Angriffspunkt. Die zugrundeliegenden molekularen Mechanismen sind bislang nur unvollständig aufgeklärt, so dass wir daran arbeiten, diese besser zu verstehen, auch um möglicherweise neue Therapieansätze zu finden.
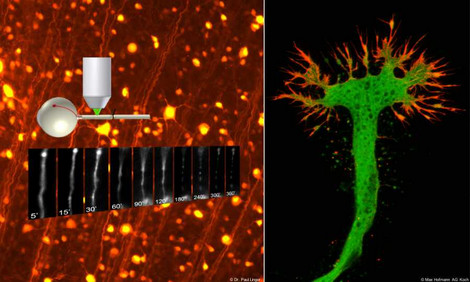
Modelle und Analysen
Wir benutzen dazu Zellkulturmodelle (primäre Neuronenkulturen, humane pluripotente Stammzellen von ALS-Patienten, u.a.) in sog. mikrofluidischen Kammern, die eine separate Analyse von Axonen ermöglichen.
Als Modelle kommen die Axotomie für die akute Läsion des Axons sowie verschiedene genetische Modulationen der Zellen zur Simulation von ALS-typischen Veränderungen (Plasmide mit Mutationen des TDP-43 Proteins, pluripotente Stammzellen, oxidativer Stress) zum Einsatz.
Dabei analysieren wir insbesondere Veränderungen des Zytoskeletts, wozu wir hochauflösende Mikroskope wie das STED-Mikroskop verwenden. Zudem untersuchen wir Autophagie und Apoptose sowie den zellulären Energiestoffwechsel und den axonalen Transport.
Forschung für die Zukunft
Im Tier haben wir eine Technik entwickelt, die mit Hilfe eines 2-Photonen-Mikroskops und entsprechend optimierter Operations- und Narkose-Methoden die Analyse des axonalen Transportes von verschiedenen zellulären Cargos (Mitochondrien, synaptische Vesikel, Endosome) im optischen Nerv der Ratte im lebenden Tier in Echtzeit erlaubt.
Dies ermöglicht die Untersuchung des axonalen Transportes im intakten Säugetier-Organismus auf zellulärer Ebene im Rahmen verschiedenster Fragestellungen, z.B. bei neurodegenerativen Erkrankungen und bei Nervenläsionen. Der axonale Transport ist essenziell zur Aufrechterhaltung der axonalen Integrität und ist bei neurodegenerativen Erkrankungen sehr früh beeinträchtigt, so dass wir uns durch diese Methode zukünftig wichtige Erkenntnisse erhoffen.
Neue Therapien für Motoneuronenerkrankungen
Klinisch arbeiten wir an der Weiterentwicklung von neuen Therapien bei Patient*innen mit Motoneuronerkrankungen, vor allem der Amyotrophen Lateralsklerose (ALS) und der Spinalen Muskelatrophie (SMA).
Wir nehmen dabei an mehreren klinischen Studien und Testung von neuen Substanzen beim Menschen teil (u.a. Fasudil, Ravulizumab) und sind aktives Mitglied im deutschen Motoneuron-Netzwerk (MND-Net). Zusammen mit Prof. Paul Lingor (nun an der TU München) haben wir das Medikament Fasudil zunächst im Tierversuch umfangreich charakterisiert und untersuchen es nun im Rahmen einer multizentrischen klinischen Studie an ALS-Patient*innen (ROCK-ALS).
Mehrere Projekte laufen zur besseren Charakterisierung des Krankheitsverlaufes und Entwicklung von Biomarkern bei ALS und SMA. Mehr Informationen zu unserer Gruppe finden Sie hier.
Leitung
Das könnte Sie auch interessieren
